Adsorción
Capas monomoleculares
Una capa monomolecular es una capa
adsorbida cuyo espesor es de una sola molécula. La cobertura completa
de una superficie con una monocapa
puede
alterar sus propiedades drásticamente. La literatura es muy extensa
por lo cual solamente abordaremos aspectos generales y mencionaremos algunas
aplicaciones de las monocapas.
Langmuir-Blodgett
Las capas de Langmuir-Blodgett, también llamadas capas LB, se forman
cuando un sustrato atraviesa una superficie líquida donde se encuentra
flotando una monocapa de una sustancia anfifílica. De este modo
la sustancia anfifílica se adhiere a la superficie del sustrato.
El proceso puede repetirse sobre una capa LB ya formada. Las capas presentan
bastante orden y los espesores son muy reproducibles. Es factible construir
capas LB con espesores de cientos de moléculas.
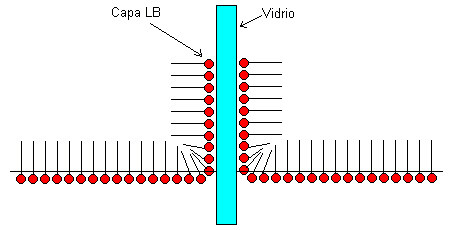
La figura muestra que las moléculas de anfífilo sobre
la superficie del vidrio adquieren una disposición prácticamente
igual a la que tenían sobre la superficie del líquido. En
casos como éste, decimos que las capas LB tienen una razón
de transferencia muy cercana a 1.
Entre las sustancias utilizadas para formar monocapas se encuentran
el araquidato de cadmio (sal del ácido araquídico, considerada
el mejor material disponible para formar películas adsorbidas) y
los estearatos, como el de bario. Este último tiene la propiedad
de ser autofóbico.
Autoensamblada
Las capas autoensambladas se forman cuando una sustancia anfifílica
tiene suficiente afinidad por un sustrato como para adsorberse espontáneamente
(ya sea física o químicamente) sobre el adsorbente. Un modo
muy usado de "fabricar" una monocapa con propiedades deseadas es añadir
un grupo tiol (-SH) a un sustrato para favorecer la adsorción sobre
una superficie de Au. Este método se usa para modificar la superficie
de un electrodo y dotarlo de sensibilidad a una sustancia en particular,
p. ej., sensibilidad a hormonas o metabolitos. Esto también explica
la preferencia por el Au, dado que, aunque la Ag y el Cu también
pueden actuar como adsorbentes de tioles, las propiedades electroquímicas
del Au son más convenientes para su uso en el laboratorio.
¿Existen algunas regularidades en el comportamiento de adsorción
de sustancias orgánicas? Una de las reglas más antiguas es
la enunciada por Traube:
Regla de Traube: "la adsorción de sustancias orgánicas
en solución acuosa aumenta de modo fuerte y regular a medida que
avanzamos en una serie homóloga."
la cual se aplica mejor a compuestos de cadena no-ramificada. De este
modo, en el caso de la adsorción de ácidos grasos sobre carbón
a partir de una solución acuosa, el ácido butírico
(CH3CH2CH2COOH) se adsorbe más
fuertemente que el propiónico (CH3CH2COOH),
que a su vez se adsorbe más fuertemente que el acético (CH3COOH).
Requisitos para el siguiente tema: revisar conceptos de química
del estado sólido, especialmente los índices de Miller para
planos cristalográficos.
Tema siguiente
Tema anterior
Vuelta al temario
Ultima actualización de esta página: 22 de septiembre
de 1999
Encargado de la página: Dr. Víctor Manuel Rosas García.
e-mail:vrosas@ccr.dsi.uanl.mx
Facultad de Ciencias Químicas
Universidad Autónoma de Nuevo León
San Nicolás de los Garza, NL, México.

