

URL: https://members.tripod.com/ l.q.i/LabDesAn/ISE.html
© D.R. Prohibida la Reproducción parcial o total de este material sin la autorización escrita de:
Dra. Perla Elizondo Martínez
Ciudad Universitaria, San Nicolás de los Garza N.L. México
Tel 83294000
Perla Elizondo Martínez
Blanca Nájera Martínez
Thelma Elizabeth Serrano Quezada
INTRODUCCIÓN
El programa de Laboratorio de Desarrollo Analítico se conforma de dos partes. En la primera parte del curso se realizan una serie de prácticas desarrolladas de acuerdo al programa de Teoría las cuales se actualizaron y se probaron.
La otra parte del curso consiste en un problema integrador, éste se diseñó de tal forma que los alumnos colaborarán con algún estudiante de licenciatura, maestría o del doctorado en su proyecto de tesis ayudándole a resolver un problema en particular, o con un investigador, con el compromiso por parte del maestro titular de darle seguimiento a los alumnos de la materia verificando su desarrollo.
El estudiante deberá aportar a su asesor ideas diferentes o nuevas para la resolución del problema asignado.
El objetivo que se pretende lograr con el problema integrador es que el alumno adquiera experiencia al enfrentarse a un problema real, responsabilidad de obtener resultados satisfactorios en un tiempo determinado y refuerce su capacidad de trabajar en equipo.
Los resultados de su proyecto los presentará en un foro estudiantil con la presencia del maestro titular e invitados.
INSTRUCCIONES PARA EL ALUMNO
Para la realización de las prácticas se requiere accesar la página de internet del Área de Química Analítica de la Carrera de L.Q.I. referente al Laboratorio de Desarrollo Analítico. Ahí encontrarás toda la información sobre la práctica que realizarás en cada sesión, tendrás que investigar, planear y organizar lo que harás antes de que la ejecutes en el laboratorio, también se incluye el trabajo de investigación que acompañará al reporte que deberás entregar una semana después de la discusión de resultados.
Grupo 1
|
Tema |
Subtema |
Horas |
Ponderación |
Actividades |
Fecha |
||
|
TE |
TU |
LAB |
|||||
|
|
0 |
0 |
4 |
6.25% |
|
18 En |
|
|
0 |
0 |
4 |
6.25% |
|
25 En |
|
0 |
0 |
4 |
6.25% |
|
1 Feb |
|
|
0 |
0 |
8 |
12.50% |
|
8 y 15 Feb |
|
|
0 |
0 |
4 |
6.25% |
|
22 Feb |
|
|
0 |
0 |
4 |
6.25% |
|
1 Mar |
|
|
|
0 |
0 |
4 |
6.25% |
|
8 Mar |
|
Examen de medio término Requisito para presentar: Entrega de Formato 018 y 019 |
8 Mar |
||||||
|
Revisión de examen de medio término |
22 Mar |
||||||
|
|
0 |
0 |
4 |
6.25% |
|
29 Mar |
|
|
0 |
0 |
4 |
6.25% |
|
29 Mar |
|
|
Fechas proyecto
6.1. Presentación inicial del tema del proyecto y objetivos 6.2 realización del proyecto
6.3. Presentación final del proyecto y entrega del reporte |
0 |
0 |
24 |
37.50% |
|
8 Mar 12 Abr, 3,10,May
17 May
24 May |
|
Examen final |
24 May |
||||||
|
Revisión de examen final |
31 May |
||||||
*Se avanzará durante todo el semestre
** Propuesta de fecha entre maestras y estudiantes
Las fechas del proyecto se podrán modificar (previo aviso) de acuerdo al avance de las prácticas
|
V EVALUACIÓN |
% |
FECHA DE REVISIÓN |
|
Examen de medio término |
25 |
8 marzo |
|
Examen final |
25 |
24 mayo |
|
Participación |
12.5 |
|
|
Reportes |
12.5 |
|
|
Trabajo de Investigación de cada práctica |
5 |
|
Proyecto
|
20 |
|
La exposición en público del proyecto de investigación es considerado como parte del examen final
El reporte del proyecto será entregado con formato de artículo científico con el VoBo del asesor
El no entregarse los reportes es causa de reprobación del curso
Deberá entregarse copia del formato 018 y 019 del proyecto avalado por la academia de Q. Analítica y del jefe de carrera como requisito para aceptarse
NOTA: Capítulo IV de las evaluaciones. Artículo 48: Para sustentar exámenes ordinarios se requiere haber asistido cuando menos al 80% del total de las clases impartidas durante el ciclo escolar.
|
Dra. Perla Elizondo Martínez |
|
M.C. Thelma E. Serrano Quezada |
|
perla.elizondomr@uanl.edu.mx |
|
serrano.thelma@gmail.com |
INSTRUCCIONES PARA EL ALUMNO:
Para la realización de las prácticas se requiere accesar la página de internet del Área de Química Analítica de la Carrera de L.Q.I. referente al Laboratorio de Desarrollo Analítico. Ahí encontrarás toda la información sobre la práctica que realizarás en cada sesión, tendrás que investigar, planear y organizar lo que harás antes de que la ejecutes en el laboratorio, se requiere que busques información sobre el tema de la práctica y te prepares para discutirla antes de iniciar tu trabajo experimental. También se incluye el trabajo de investigación que acompañará al reporte que deberás entregar una semana después de discutir los resultados de la práctica.
CONTENIDO
INTRODUCCIÓN 2
Objetivos, justificación y alcance del curso
Metodología de trabajo y reglamento de seguridad
EQUILIBRIO QUÍMICO 10
Efecto de la fuerza iónica sobre la respuesta de un electrodo de ion selectivo (ISE)
Trabajo de Investigación 11
Determinación de una constante de equilibrio por conductimetría 12
Trabajo de Investigación 15
Efecto de las reacciones laterales sobre el equilibrio de una sal poco soluble 16
Trabajo de Investigación 16
Medición de coeficientes de reacciones laterales por espectrofotometría 17
Trabajo de Investigación 18
Diagramas pH-potencial 19
Trabajo de Investigación 21
VALORACIONES DE COMPLEJOS 22
Determinación del error de valoración 22
Trabajo de Investigación 22
SOLVENTES NO-ACUOSOS 23
Valoración de un sistema en disolventes no acuosos
Trabajo de Investigación 24
TÉCNICAS DE SEPARACIÓN 25
Separación y análisis de una mezcla de metales 26
Trabajo de Investigación
BIBLIOGRAFÍA 27
Práctica No 1
EFECTO DE LA FUERZA IÓNICA SOBRE LA RESPUESTA DE UN ELECTRODO DE ION SELECTIVO (ISE)
Objetivo. Discutir y evaluar la influencia de la fuerza iónica del medio sobre la respuesta de un electrodo de ion selectivo.
Preparación de disoluciones.
100 mL de estándares de a)Pb(ClO4)2 de las siguientes concentraciones: 10-2 , 10-3 , 10-4 Molar en Pb(II). b) Cd(NO3)2 de las siguientes concentraciones: 10-2 , 10-3 , 10-4 Molar en Cd(II). c) AgNO3 de las siguientes concentraciones: 10-2 , 10-3 , 10-4 Molar en Ag(I)
Stock de NaClO4 7 M
Stock NaNO3 5 M
Procedimiento.
Conectar el electrodo de ion selectivo al potenciómetro.
Poner en modo de mV con la ayuda de la tecla mode.
Transferir 50mL del estándar más diluido a un vaso de precipitado de 150mL. Añadir el volumen necesario de ISA para ajustar la fuerza iónica a aproximadamente 0.1 y agitar.
Introducir el electrodo en la disolución, tomar la lectura esperando a que ésta se estabilice.
Enjuagar el electrodo.
Repetir los pasos 3 y 4 para el resto de los estándares en orden creciente de concentración.
Agregar un volumen adicional de ISA a cada una de las disoluciones anteriores de tal manera que la fuerza iónica se ajuste aprox. 0.5.
Tome las lecturas correspondientes de las disoluciones a la nueva fuerza iónica.
Repetir los pasos 7 y 8 ajustando la fuerza iónica aprox. 0.9
Repetir los pasos 7 y 8 ajustando la fuerza iónica aprox. 1.6
Construir las curvas de calibración a las diferentes fuerzas iónicas
Discusión de resultados y conclusiones.
Deberá saber el funcionamiento del potenciómetro y el procedimiento para realizar la práctica.
Describa el funcionamiento de un electrodo de ión selectivo de estado sólido.
Describa con detalle la preparación de disoluciones aún que usted no las haya preparado.
En cuál de las disoluciones es mayor el efecto de la variación de la fuerza iónica?. Fundamente su respuesta.
De acuerdo a los resultados obtenidos sugiera el intervalo óptimo de fuerza iónica para el adecuado funcionamiento del ISE.
Cuáles son los criterios para la selección de un buen ajustador de fuerza iónica?.
En qué determinaciones es importante el ajuste de la fuerza iónica?. Fundamente su respuesta.
Realizar un resumen de no más de una hoja una aplicación real donde es importante ajustar la fuerza iónica, basándose en bibliografía en inglés y/o por Internet.
En un anexo del reporte deberá describir detalladamente y paso a paso el manejo del aparato que utilizó
Investigue la factibilidad para determinar constantes de equilibrio de complejos utilizando electrodos de ion selectivo, proponga el procedimiento y cuál sería el tratamiento matemático detallado para determinarlas?
PRÁCTICA No 2
DETERMINACIÓN DE UNA CONSTANTE DE EQUILIBRIO POR CONDUCTIMETRÍA
Objetivo. Evaluar la constante de equilibrio de un sistema empleando una técnica conductimétrica.
Conocer la relación entre coeficiente de actividad y fuerza iónica.
Saber la relación que existe entre conductancia específica y conductancia equivalente.
La intensidad de una corriente eléctrica que pasa por un conductor, esto es la cantidad de electricidad que fluye por segundo, determinada por la diferencia de potencial aplicado a través del mismo y por la resistencia ofrecida por el conductor a la corriente; esta dada por la siguiente expresión:
I=E/R
Donde I es la intensidad de la corriente que fluye por una resistencia R bajo un potencial aplicado.
La resistencia de un conductor electrolito al paso de la corriente se puede determinar mediante la ley de Ohm, pero es de costumbre en lugar de resistencia hacerlo por conductancia, que es simplemente el recíproco de la resistencia eléctrica
Sabemos que la resistencia de un conductor cualquiera es directamente proporcional a su longitud e inversamente al área de su sección transversal es decir:
R= ρ(l/A)
Donde R es la resistencia en Ohmios, (l) la longitud en centímetros, (A) es el área en centímetros cuadrados y (ρ) la resistividad o resistencia especifica cuyo valor depende de las características y naturaleza del conductor. Es por eso que de la ecuación se puede deducir que la expresión de la conductancia es la siguiente:

L= σ(A/l)
Donde (σ=1/ρ) es la conductancia específica del conductor esta cantidad puede considerarse como la conductancia de 1 cubo de 1 cm de arista de cierto material y se expresa en recíprocos de ohmios o Siemens por centímetro.
Aunque la conductancia específica es una propiedad del medio al tratar con soluciones de electrolitos, existe otra cantidad de mayor significado que es la conductancia equivalente (Λ) que en un electrolito esta definida como el volumen de solución que contiene un peso equivalente de la sustancia disuelta cuando se coloca entre dos electrodos paralelos entre sí a una distancia de 1 cm y suficientemente grandes para contener entre ellos toda la solución. Esta no se determina nunca directamente, sino que se calcula desde la conductancia específica, mediante la siguiente ecuación:

Se podría usar directamente σ si tuviéramos la certeza de que el valor de la constante de la celda (A/l) fuera 1.
Uno de los factores que afecta la conductancia equivalente es la posible disociación limitada del electrolito. Nuestro sistema bajo estudio es el ácido acético el cual es un electrolito débil, no se disocia totalmente en solución, éste presenta un equilibrio entre los iones y el electrolito asociado.
La constante aparente de equilibrio para la disociación puede calcularse mediante la siguiente ecuación
HA ⇄ H+ + A-

Donde HA es el ácido acético, H+ son los iones hidrogeno y α es el grado de disociación y C es la concentración del soluto.
Sobre la base de la teoría de Arrhenius, la conductividad equivalente a cualquier concentración se relaciona con el grado de disociación por
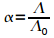
Donde Λ es la conductividad equivalente a la concentración C y Λ0 es la conductividad equivalente a la dilución infinita.
Tanto la conductancia específica como la equivalente de una solución varía con la concentración. Para electrolitos fuertes a concentraciones de hasta varios equivalentes por litro, la conductancia específica aumenta marcadamente con el incremento de concentración, en contraste las conductancias especificas para electrolitos débiles comienzan con valores más bajos en soluciones diluidas y se incrementan mucho más gradualmente. En ambos casos el incremento de conductancia se debe al incremento en el número de iones por centímetro cúbico por unidad de volumen de la solución.
De manera contraria a lo que sucede con la conductancia específica, la conductancia equivalente de los electrolitos fuertes y débiles aumenta con la dilución; la razón de esto es que la disminución en la conductancia específica, es mayor al compensado por el incremento en el valor de (1/C) por dilución, y por lo tanto asciende.
Equipo y Material:
Conductímetro Orión 162
Celda de conductividad
Material de vidrio
Reactivos y Preparación de disoluciones:
100 mL de solución de ácido acético de las siguientes concentraciones: 0.05, 0.025, 0.0125, 0.00625, 0.00312 y 0.00156 N.
Estándar de NaCl de 1413 µS/cm
Calibración del conductímetro Orión modelo 162
Tomar las lecturas de cada una de las muestras colocándolas en un vaso de precipitado de 50 mL introduciendo la celda de conductividad en la solución, cheque que la muestra cubra perfectamente la celda, esperar hasta que se estabilice la lectura y tomar nota del valor. Enjuague la celda perfectamente con agua destilada y secar. Repetir este paso con todas las soluciones( se recomienda que durante la medición la celda este sujeta a unas pinzas para evitar los movimientos ocasionados por el pulso de la mano)
Tomar las lecturas de conductividad cada 30 segundos por 2 minutos, para posteriormente sacar un promedio de las mediciones.

Para la realización del reporte, en la parte de tratamiento de los datos, detalle adecuadamente las unidades en que está llevando a cabo su determinación
Deberá conocer el funcionamiento del conductímetro y las unidades de lectura del mismo.
Diseñe el procedimiento para lograr el objetivo de la práctica
Sacar un promedio de las conductividades específicas de cada concentración y transformarlas a conductividad equivalente.
Obtener el valor de grado de disociación tomando en cuenta la conductividad equivalente a dilución infinita.
Calcule la conductividad equivalente a dilución infinita con base a los resultados experimentales.
Compare el valor anterior con el investigado en la bibliografía, justificando la diferencia.
Obtener la constante de acidez y posteriormente el coeficiente de actividad de la especie.
Con el coeficiente de actividad de la especie obtener el valor de la constante de equilibrio.
Discuta con fundamento el porqué de las diferencias entre el valor reportado en bibliografía y el encontrado experimentalmente.
La constante encontrada experimentalmente es termodinámica o de qué tipo, si no lo es que sería necesario para que lo fuera, fundamente su respuesta.
Investigue como se determina la relación metal-ligando de un complejo por conductimetría.
Qué otro tipo de constantes de equilibrio es posible determinar por conductimetría, detalle el procedimiento y tratamiento matemático para su determinación
PRÁCTICA N° 3
EFECTO DE LAS REACCIONES LATERALES SOBRE EL EQUILIBRIO DE UNA SAL POCO SOLUBLE
Objetivo.
Determinar la solubilidad de una sal a diferentes valores de pH
Evaluar la influencia del pH en la solubilidad del compuesto.
Construir un Diagrama pH- S
Sistema propuesto
Disolución saturada de ZnCO3 a pH 4, 7 y 10.
El estudiante deberá: a) seleccionar la técnica y diseñar el procedimiento que le permita seguir las variaciones de la solubilidad de la sal a diferentes valores de pH.
b) Registrar los resultados obtenidos en una tabla y graficarlos para obtener un diagrama pH Vs S.
c) Evaluar los resultados y concluir acerca del comportamiento del sistema.
d) Acudir al menos una semana antes de la práctica con los auxiliares responsables de la preparación de los reactivos a verificar que el equipo y los reactivos que utilizará estén en existencia
Proponga un método para determinar la solubilidad del ZnCO3 considerando la influencia del pH.
Fundamente las razones de su propuesta justificando su selección.
De acuerdo al método seleccionado establezca el procedimiento que seguiría para realizarlo experimentalmente.
Con base a los resultados experimentales obtenidos construya un diagrama de solubilidad Vs pH .
Discuta la influencia del pH en la solubilidad del compuesto.
Discuta la influencias de otras especies presentes en su determinación
Sugiera el intervalo de pH óptimo para la precipitación cuantitativa del cinc.
En un anexo del reporte describa detalladamente el funcionamiento del equipo que utilizó.
Detalle la preparación de cada una de las disoluciones que utilizó
DETERMINACIÓN DE COEFICIENTES DE REACCIONES LATERALES POR ESPECTROFOTOMETRÍA
Objetivo. Medir el coeficiente de reacción de un ion metálico con un ligando o un ion metálico interferente ( αM (L) o αM (L) ), evaluar la extensión de la reacción secundaria y su efecto sobre el sistema principal.
Sistema propuesto. Fierro(II)-1,10-fenantrolina en un medio de pH 5 utilizando clorhidrato de hidroxilamina como reductor y como ligando o ion metálico interferente:
El ion citrato.
El EDTA
Zn(II)
Cd(II)
Preparación de disoluciones.
Sulfato de fierro(II) y amonio 0.0005M
1,10-Fenantrolina 0.0005M
Regulador de ácido ácetico-acetato de sodio pH 5.
Clorhidrato de hidroxilamina 5% p/v.
Disolución al 5% p/v del ligando o ion metálico interferente interferente.
En este método se mantiene constante la suma de las concentraciones molares de los dos reactivos pero se varía su relación. La abscisa del pico extrapolado corresponde a la relación presente en el complejo.
Transfiera a matraces de aforación de 25mL disoluciones que contengan una relación en volumen (mL) de ion metálico-ligando de:
|
Metal |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Ligando |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
Se añade posteriormente 10mL de la disolución buffer y 1mL de clorhidrato de hidroxilamina, aforar hasta la marca con agua destilada y mezclar bien. Mídase la absorbancia de cada disolución a una longitud de onda de 510 nm después de esperar 5 minutos. Prepare de nuevo las mismas disoluciones agregándole a cada una, 2.5mL de la disolución del ligando interferente antes de aforar y mida la absorbancia de cada disolución a la misma longitud de onda.
Método. Razón de moles
Describir el procedimiento detalladamente
Describa el procedimiento para el método de razón de moles.
Deberá conocer el manejo del instrumento que utilizará para realizar la práctica.
Desarrolle el procedimiento para el método de razón de moles.
Desarrolle el procedimiento para el método de variaciones continuas.
De los datos experimentales obtenidos determine la estequiometría del complejo.
Calcule la constante termodinámica, la constante condicional y el coeficiente de equilibrio lateral. Compare sus resultados con los valores reportados en la literatura.
Con base a sus resultados, evalúe el efecto que tiene sobre el equilibrio principal la presencia de la especie interferente.
Describa detalladamente la preparación de todos los reactivos utilizados durante el desarrollo de la práctica.
Compare los resultados por ambos métodos experimentales.
En un anexo del reporte describa el funcionamiento del aparato que utilizó
Objetivo. Obtener el diagrama pH-potencial del sistema Fe(III)/Fe(II) en medio acético
En ausencia de EDTA
En presencia de EDTA
La relación entre coeficiente de actividad y fuerza iónica.
El efecto que sobre el potencial redox tiene la presencia de sustancias capaces de formar complejos o compuestos poco solubles con las formas oxidada y/o reducida del par.
El concepto de potencial formal de un electrodo.
Fundamento.
La aplicación de los datos de potencial de electrodo a muchos sistemas de interés se complica debido a los equilibrios de solvólisis, asociación, disociación y formación de complejos con especies que forman un sistema redox y que aparecen en la ecuación de Nernst. Para tomar en cuenta estos fenómenos es necesario conocer su existencia y disponer de los datos de las constantes de equilibrio apropiadas.
Los potenciales formales son potenciales obtenidos empíricamente para compensar los efectos de la actividad y los equilibrios competitivos que pudieran estar presentes en el medio. Estos potenciales permiten discernir acerca del comportamiento electroquímico del sistema redox bajo condiciones determinadas y por ello son de mucho mas valor práctico para el químico que los potenciales estándar.
El potencial estándar Eo de un sistema es el potencial de la semicelda (en relación con el electrodo normal de hidrógeno) medido en condiciones tales que la relación de concentraciones analíticas de reactivos y productos, tal como aparecen en la ecuación de Nernst, es exactamente la unidad, y las concentraciones de todas las demás especies en el sistema se especifican claramente.
Si en la ecuación de Nernst se utilizan los potenciales formales en lugar de los potenciales estándar de electrodo se logra una mejor concordancia entre los valores calculados y los resultados experimentales, siempre que la concentración de los electrolitos de la solución se aproxime a aquella en la que se ha establecido el potencial formal. Si los potenciales formales se aplican a sistemas que son muy diferentes, tanto en el tipo como en la concentración de electrolitos, se pueden originar errores mayores de los que resultan del uso de potenciales estándar de electrodo.
La obtención del gráfico de potencial formal contra pH permite evaluar las afectaciones en este parámetro por el pH del electrolito. Estos diagramas son muy útiles sobre todo cuando es necesario precisar las condiciones óptimas para la valoración potenciométrica de iones metálicos por formación de complejos.
Procedimiento experimental.
A. Obtención del diagrama pH-E del sistema seleccionado en ausencia de EDTA.
Preparar 100 mL de una solución de la siguiente composición: FeCl3 0.01M ; Sal de Mohr 0.01M ; HOAc 0.1M y NaClO4 0.3M. Completar a 100 mL con agua destilada.
Pasar 50 mL (aprox.) de esta solución a la celda potenciométrica.
Colocar el agitador, los electrodos y pasar una corriente de nitrógeno por 10 minutos con la celda cerrada.
Obtener la primera lectura del potencial con los electrodos de platino.
Adicionar pequeños volúmenes de NaOH 0.5M. Obtenga los valores de potencial y pH después de cada adición del hidróxido. Concluir el experimento cuando se aprecie un precipitado pardo de Fe(OH)3.
B. Obtención del diagrama pH-E del mismo sistema en presencia de EDTA.
Preparar 100 mL de una solución de la siguiente composición: FeCl3 0.01M ; Sal de Mohr 0.01M ; HOAc 0.1M ; EDTA 0.04M y NaClO4 0.3M. Completar a 100 mL con agua destilada.
Proceder de igual manera que en el caso anterior variando el pH con solución de NaOH 0.5M.


Trabajo de investigación.
Investigue como montar el equipo para la realización de la práctica.
Deberá conocer el funcionamiento de cada uno de los equipos utilizados para la realización de la práctica
Diga el nombre de todos los componentes que formarán parte del sistema donde se llevará a cabo la práctica
Discuta la función de cada uno de los componentes anteriores y mencione como van las conexiones de electrodos y porqué.
Graficar los resultados para obtener los diagramas pH-E en ausencia y presencia de EDTA.
Compare ambos diagramas y seleccione a partir de los mismos el valor óptimo de pH para efectuar la valoración potenciométrica de Fe3+ con EDTA
Calcule el pH teórico y compárelo con el experimental.
Discuta las diferencias entre los dos valores.
En un anexo del reporte describa detalladamente ayudándose de un dibujo como se conectan cada uno de los materiales utilizados y el funcionamiento de los equipos.
PRÁCTICA N° 6
“DETERMINACIÓN DEL ERROR DE VALORACIÓN”
Objetivo. Evaluar el error de valoración de un sistema metal-ligando en función de la concentración del ligando.
Realice el procedimiento con base a un sistema propuesto por usted ajustando las condiciones del método.(Puede consultar el Handbook of Analytical Chemistry, Louis Meites.)
Indicaciones
Al menos una semana antes de la práctica deberá acudir con los auxiliares responsables de la preparación de las soluciones para revisar que los reactivos se encuentren en existencia.
A partir de los datos experimentales estime el error de valoración.
Enumere las posibles causas de error en una valoración complejimétrica.
Cuál es la principal fuente de error en el método utilizado.
Compare el valor del error con el estimado por sus compañeros y saque sus propias conclusiones.
Sugiera algún cambio en las condiciones del método para disminuir el error en la determinación.
Cómo se puede reducir al mínimo el error causado por el uso de indicadores visuales.
PRÁCTICA No 7
Objetivo. Evaluar el efecto del solvente en la valoración de un mismo analito llevándola a cabo en dos medios diferentes.
Equipo y Material:
Titulador Automático
Electrodo de vidrio
Electrodo de calomel
Reactivos y Preparación de disoluciones:
HClO4 0.1M en agua
Piridina 0.1M en agua
Piridina 0.1M en HOAc
HClO4 0.1 M en HOAc, agregando 15 ml de anhídrido acético por cada litro de disolución
Ftalato ácido de potasio
Estandarización del HClO4
Se estandariza con ftalato ácido de potasio en ácido acético para la valoración no acuosa y con carbonato de sodio en agua para la acuosa.
Procedimiento.
Las valoraciones acuosa y no acuosa se llevan a cabo en un titulador automático utilizando electrodos de vidrio y de calomel o uno combinado. (Para el manejo del mismo ver procedimiento correspondiente, que deberá saberlo antes de la práctica)
Utilizar 25 ml de la disolución de Piridina 0.1 M en agua, valorarla con la disolución de HClO4 en agua previamente estandarizado.
Repetir la titulación utilizando la disolución de piridina 0.1 M en HOAc, valorarla con la disolución de HClO4 en HOAc previamente estandarizado, sólo a ésta agregarle 8 gotas del indicador.
Trabajo de Investigación
Conocer el funcionamiento del titulador automático
Trazar las curvas de valoración en una misma gráfica.
Determine el punto de equivalencia y calcule la concentración de la piridina en la muestra problema.
Haga un análisis de las curvas de valoración, compare y reconozca las diferencias y semejanzas entre ellas y saque conclusiones considerando su análisis.
Proponga las condiciones para la valoración de la piridina por un método clásico, es decir sin utilizar ningún instrumento y realice un análisis con base en la comparación entre las ventajas y desventajas de ambas técnicas
Sugiera dos disolventes que podrían usarse en lugar del HOAc, justifique su respuesta.
Sugiera dos pares de solvente-valorante para determinar satisfactoriamente fenol.
Escriba cómo serían los cálculos en cada etapa de la valoración en HOAc si ésta se hubiera llevado a cabo de manera clásica.
Qué modificaciones se le hacen al electrodo de referencia de calomel en la valoración con disolventes no acuosos.
En un anexo del reporte deberá detallar el funcionamiento del aparato
PRÁCTICA No 8
SEPARACIÓN Y ANÁLISIS DE UNA MEZCLA DE METALES
Objetivo. Aplicar la técnica de Cromatografía por Intercambio Iónico para la separación cuantitativa de una mezcla de iones metálicos y su posterior determinación por alguna técnica analítca seleccionada.
Sistema propuesto. Mezcla de sales de Fe(III), Co(II), Ni(II), Cu(II) y Zn(II) en un medio HCl 9.0N
Intercambiador aniónico tipo Dowex 1 – XB malla 100 – 200
HCl en concentraciones 9.0N, 4.0N, 2.5N, 0.5N y 0.005N.
Procedimiento.
Se añade inicialmente a la columna previamente empacada, aproximadamente 10 mL de HCl 9.0N en dos porciones permitiendo que fluyan de 2 ó 3 mL/min. Dejar que salga hasta que esté incoloro cuidando que el nivel del líquido por encima de la resina sea de aproximadamente 2 cm.
Haga pasar una alícuota de 2 mL de la mezcla a través de la columna. Eluya el níquel con 90 mL de HCl 9N en porciones de 15mL, utilice un vaso de precipitado de 250 mL para recoger el eluato, mismo que deberá cambiar cada vez que eluya un catión diferente, cuide que la velocidad de flujo sea de aproximadamente 2 ó 3 mL/min. A continuación eluya el Co(II) con 100mL de HCl 4N en 10 porciones. Después añada a la columna 100mL de HCl 2.5N en porciones de 10mL para eluir el Cu(II). Continúe ahora con 90mL del ácido 0.5N y después con 100mL del ácido 0.005N ambos en porciones de 10mL para eluir el Fe(III) y el Zn(II) respectivamente. Por último enjuague la resina con agua para que quede lista para nuevas elusiones. Deberá dejarla con el nivel de agua hasta 2 cm arriba del nivel de la resina.
Proceda a efectuar el análisis de cada uno de los iones metálicos separados siguiendo las técnicas analíticas seleccionadas para cada caso.
Dos semanas antes deberá ir con los auxiliares y preguntarle que muestra problema le tocó.
Trabajo de Investigación
Investigue la metodología para empacar adecuadamente una columna de intercambio iónico.
Discuta el procedimiento de separación de los iones metálicos sugerido anteriormente.
Escriba las reacciones para cada ión metálico llevadas a cabo durante el intercambio
Investigue los procedimientos analíticos para determinar los diferentes iones metálicos.
La separación de los iones metálicos se podrá llevar a cabo por una técnica batch? fundamente y justifique su respuesta.
Qué procedimiento seguiría para llevarla a cabo por una técnica batch
Evalúe la eficiencia de la separación
Manual de Laboratorio de Desarrollo Analítico en Internet, Academia de Química Analítica, L.Q.I.
Pecsok, Shields, Métodos Modernos de Análisis Químico, 2a edición, Reverté, 1990
Handbook of Analytical Chemistry, Louis Meites. 1976
Journal of Analytical Chemistry
Journal of Chemical Education
Journal Coordination Chemistry
Chimica Acta
Internet
Dra. Perla Elizondo Martínez
M.C. Thelma Elizabeth Serrano Quezada
Enero 2011