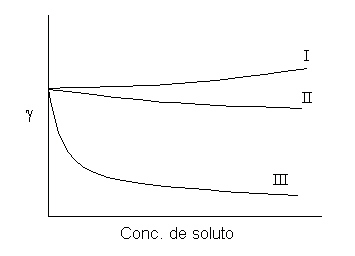
En el caso de sales iónicas en agua, éstas tienden a solvatarse fuertemente, lo cual es equivalente a aumentar el grado de asociación del agua. Esto resulta en un ligero aumento en la tensión superficial (curva I en la figura).
Si el solvente no solvata fuertemente un soluto, se producirá una disminución de las interacciones intermoleculares del líquido, lo cual producirá un descenso en la tensión superficial (curva II). Algunas sustancias, en bajas concentraciones, disminuyen bruscamente la tensión superficial; y, a partir de una concentración crítica, mantienen una valor casi constante de (gamma) (curva III). A dichas sustancias se les llama tensioactivos o surfactantes. Entre los surfactantes más conocidos están los jabones y los detergentes.

Consideremos el caso de etanol y agua: el etanol tiene una (gamma) de aproximadamente 23, mientras que el agua tiene una (gamma) de aproximadamente 73. Experimentalmente, se encuentra que el etanol actúa como un tensioactivo. El problema es: cómo explicaremos semejante observación. Recordando nuestra racionalización anterior de la diferencia entre ambas tensiones superficiales podemos argumentar que el brusco descenso se debe a que los extremos hidrocarbonados del etanol se concentran en la superficie. Dicha explicación es razonable si tomamos en cuenta la propiedad hidrofóbica de la parte hidrocarbonada. Ahora debemos preguntar: ¿es posible encontrar argumentos, ya sean termodinámicos o cinéticos, que justifiquen dicha explicación? Ese será el tema de la siguiente sección.
Encargado de la página: Dr. Víctor Manuel Rosas García.
e-mail:vrosas@ccr.dsi.uanl.mx
Facultad de Ciencias Químicas
Universidad Autónoma de Nuevo León
San Nicolás de los Garza, NL, México.